육안 청결: 규제 지침 명료화
토머스 앨트먼, 세척 검증 담당 글로벌 CIP/COP 기술 매니저

육안 청결은 거의 모든 제약 규정(FDA, PIC/S, GMP)에서 사용되는 용어입니다. 간단히 말해서, 의약품 제조용 장비는 사용 전에 육안 청결 검사를 실시해야 합니다1.
당연한 말입니다. 하지만 표준운영절차에서 육안 청결이 무엇을 의미하는지, 세척 검증에서 이를 어떻게 문서화해야 하는지 100% 명확히 아는 사람은 별로 없습니다. 가장 흔한 질문은 다음과 같습니다.
- 잔류물은 어떤 형상인가?
- 육안 임계값이란 무엇인가?
- 구성 재료가 가시성에 어떤 영향을 주는가?
- 조사관은 시력 검사를 얼마나 자주 받아야 하는가?
아래에 각 문제에 대한 간략한 설명이 있습니다.
잔류물은 어떤 형상인가?
조사관은 장비를 검사할 때 무엇에 주목해야 하는지 알아야 합니다. 공정 잔류물과 세제나 살균제 잔류물을 철저히 구별하고, 각 유형의 잔류물이 나타나는 최저치가 어느 정도인지 알아야 합니다. 또한 강재의 변색, 흠집 또는 다음 생산 단계에 영향을 주지 않는 기타 손상을 포함해 육안 청결 표면일 때 어떻게 보이는지 주지하고 있어야 합니다.
예를 들어 활성제약성분(API)은 종종 분말로 남고 세제 잔류물은 표면 얼룩으로 남기도 합니다.

API 잔류물은 종종 분말 형태로 남습니다.

세제 잔류물은 얼룩으로 남습니다.
'육안 청결' 조사관은 종종 세제 잔류물을 놓칩니다. 식음료 응용 분야용으로 개발된 세제를 사용하는 의약품 제조사는 부식 억제제 또는 특정 표면활성제와 같은 비수용성 세제 잔류물이 남아서 API 잔류물과 예상치 못한 상호 작용을 일으키기도 하고 이후 제조하는 제품에 유입되기도 함을 알아야 합니다.
구성 재료가 외관에 어떤 영향을 주는가?
검사 대상 장비의 구성 재료에 따라 잔류물은 다르게 보일 수 있습니다. 의약품 제조용 장비 소재의 약 90%는 스테인리스강이 차지하고 나머지의 대부분은 유리, 고무, 테프론과 EPDM 같은 고분자 재료입니다.
장비 선택과 조사관 교육에서 한 가지 고려할 점은 고분자 표면의 잔류물을 발견하기가 스테인리스강으로 된 장비의 잔류물을 발견하기보다 더 어렵다는 것입니다.
다시 말해서, 고온에 노출된 스테인리스강 장비는 시간이 지나면서 변색되거나 변색될 가능성이 있어 처음 장비가 들어왔을 때보다는 잔류물을 찾아내기가 더 어려워집니다. 흠집이 생긴 장비 표면은 육안 청결로 안전을 확인할 수 없게 된다면 재연마(가능하다면)하거나 교체해야 합니다.

조사관은 각기 다른 표면에서 각기 다른 잔류물이 어떻게 보이는지 찾아내도록 훈련받아야 합니다.

서로 다른 재료 마감 상태도 잔류물 외양에 영향을 줄 수 있습니다(스테인리스강과 테프론 또는 새제품/연마 처리한 스테인리스강 대비 변색된 스테인레스강).
육안 임계값이란 무엇인가?
육안 임계값은 API 또는 잔류물이 육안으로 보이게 되는 농도를 말합니다. 제조사들은 각 API 또는 잔류물에 대해 육안 임계값을 결정한 후 이를 API 또는 잔류물이 독성학적으로 유의미해지는 농도와 비교해야 합니다. 육안 임계값이 API 또는 세척 잔류물에 대해 미리 정해둔 독성학적으로 유의미한 농도보다 낮으면 육안 청결이 유효한 방법입니다.
아래 분석은 파라세타몰(상대적으로 위험이 낮은 API)이 육안에 보이게 되는 농도를 보여줍니다.
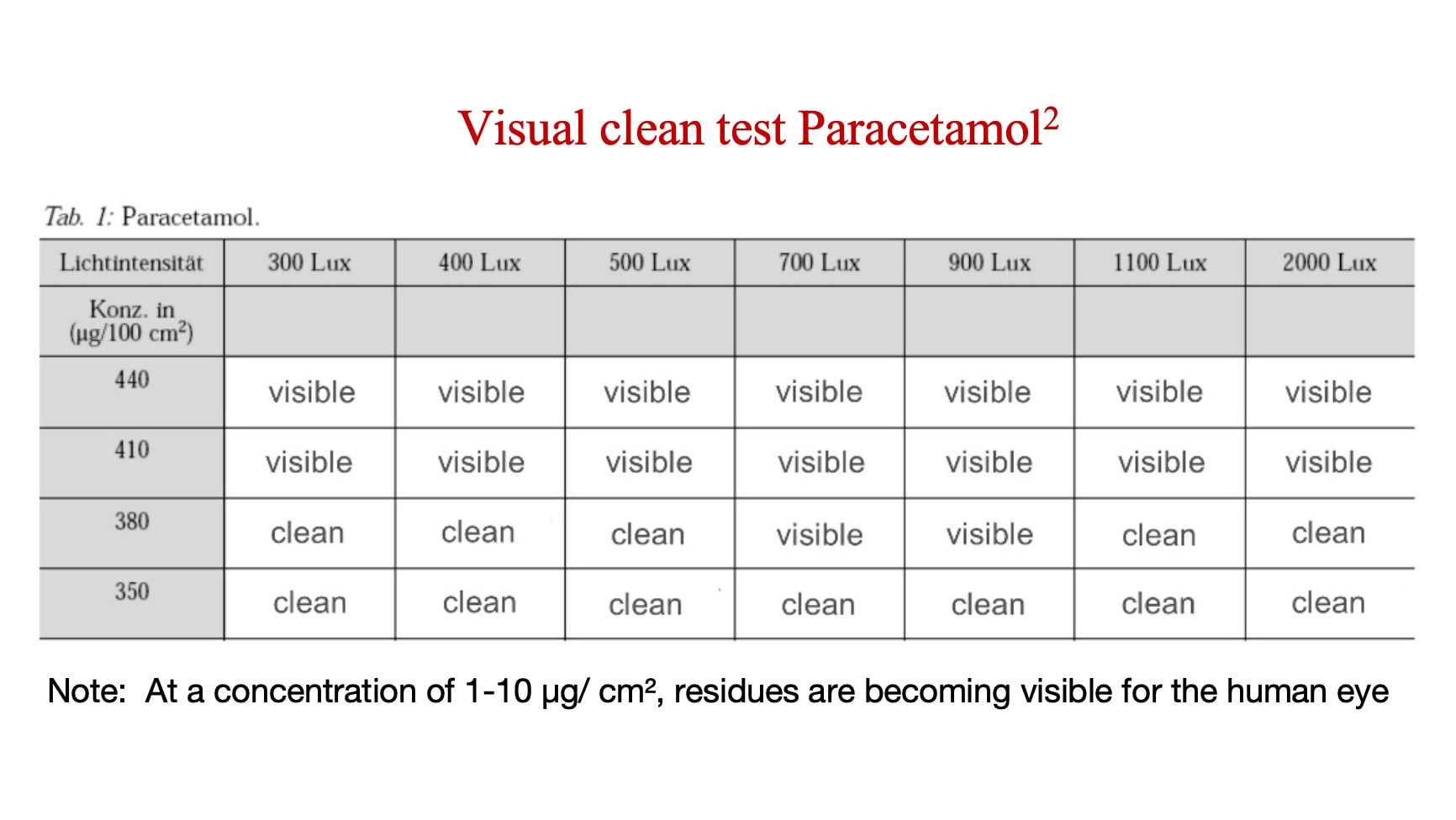
조사관은 시력 검사를 얼마나 자주 받아야 하는가?
다시 말하지만, 이 가이드라인은 특정적이지 않습니다. 육안 검사를 수행하는 작업는 모두 해마다 시력 검사를 받아야 한다고 많은 기업에서 현재 규정하고 있습니다.
법적 요구사항은 아닙니다. 그러나 세척 절차에 의문이 생겼을 때, 담당 조사관에게 철저한 교육을 제공하고 정기적으로 시력 검사를 실시했다고 문서화하면 기업측에서 합당하게 예상할 수 있는 모든 일을 했다고 규제 당국을 설득하는 데 도움이 될 것입니다.
추가 질문이 있습니까?
모범사례 및 육안 청결 가이드라인 관련 자세한 내용은 이콜랩 Life Sciences에 문의해 주십시오. 이콜랩은 전 세계의 의약품 제조사 현장에서 협력하고 있으며 다른 제조사들이 세척 검증 프로그램에 육안 청결을 어떻게 구현하는지에 대해 통찰력 있는 정보를 제공할 수 있습니다.
1FDA - 21 CFR 파트 211.67 (6)에서 사용 직전 장비 청결 검사 필수
2Pharm. Ind. 62, Nr. 6 (2000) Buscalferri et al. − Reinigungsvalidierung


